|
|
|
|
|
|
|
|
|
|
|
|
|
Тема
|
Початкові хімічні поняття
|
|
|
|
|
|
|
|
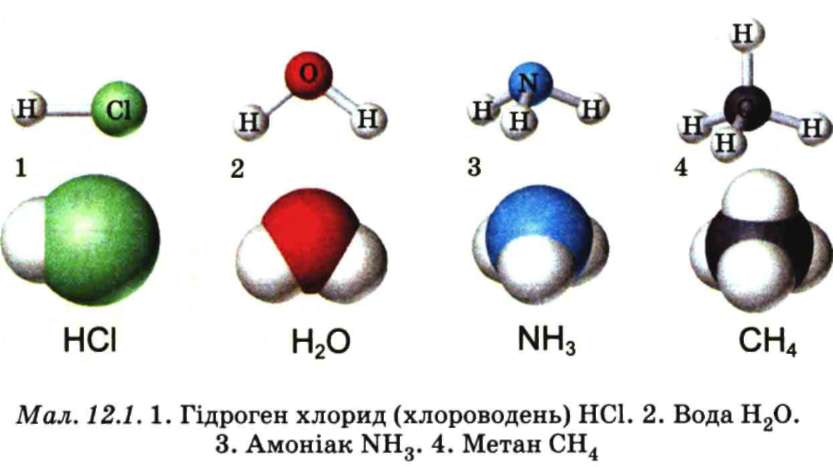
якісний і кількісний склад сполук, формули яких НС1, Н2O, NH3, СН4(мал. 12.1).
За якісним складом ці речовини дещо подібні: до складу кожної з молекул входять атоми Гідрогену. Проте їхній кількісний склад різний. Атоми Хлору, Оксигену, Нітрогену, Карбону сполучені відповідно з одним, двома, трьома й чотирма атомами Гідрогену.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цю закономірність ще на початку XIX століття підмітив Дж. Дальтон. Згодом Й.Я. Берцеліус виявив, що найбільша кількість атомів, сполучена з атомом хімічного елемента, не перевищує певної величини. У 1853 р. Е. Франкленд назвав сполучною силою здатність атомів зв'язувати або заміщувати певну кількість інших атомів. Термін «валентність» (від лат. valentia - «сила») запропонував у 1868 р. німецький хімік К.Г. Вігельгауз.
Валентність (від лат. valentia — «сила«) — загальна властивість атомів. Вона характеризує здатність атомів хімічно (валентними силами) взаємодіяти один з одним.
Валентність багатьох хімічних елементів визначили на підставі експериментальних даних про кількісний і якісний склад речовин. За одиницю валентності було взято валентність атома Гідрогену. Якщо атом хімічного елемента сполучений з двома одновалентними атомами, то його валентність дорівнює двом. Якщо він сполучений з трьома одновалентними атомами, то він тривалентний і т. д. Найвище значення валентності хімічних елементів - VIII. Валентність
|
|
|
|
|
|
|
|
|
|
|
|
